คำชี้แจงเรื่องจริยธรรม
การศึกษาในหลอดทดลองนี้ดำเนินการโดยยึดตามแนวทางจริยธรรมของปฏิญญาเฮลซิงกิ โครงการวิจัยนี้ได้รับการอนุมัติทางจริยธรรมจากคณะกรรมการจริยธรรมการวิจัยในท้องถิ่นของคณะทันตแพทยศาสตร์ มหาวิทยาลัยดามัสกัส (UDDS-693-07092020/SRC-1450) และได้รับทุนจากมหาวิทยาลัยดามัสกัส (ผู้ให้ทุนหมายเลข 501100020595)
การเตรียมอาหารเลี้ยงเชื้อของวุ้น Mitis Salivarius
จานเพาะเชื้อที่บรรจุอาหารเลี้ยงเชื้อที่เลือกไว้ได้รับการเตรียมไว้ล่วงหน้าในช่วงการเก็บตัวอย่าง โดยละลาย Mitis Salivarius Agar (MS Agar) 90 กรัมต่อลิตร (HiMedia, Maharashtra, India) ในน้ำกลั่นและเติมซูโครส 20% จากนั้นจึงนำส่วนผสมไปวางในเครื่องฆ่าเชื้อแบบเปียก (JSAT-85; JSR®, Chungchungnam-Do, South Korea) ที่อุณหภูมิ 110 °C และความดัน 15 psi เป็นเวลา 15 นาที เมื่อส่วนผสมเย็นลงเหลือ 50 °C เติม bacitracin 0.2 IU/ml (Fagron, Glinde, Germany) ลงไป จากนั้นจึงเทอาหารเลี้ยงเชื้อลงในจานเพาะเชื้อที่ผ่านการฆ่าเชื้อแล้วและปล่อยให้เย็น จากนั้นจึงคว่ำอาหารเลี้ยงเชื้อลงในตู้เย็นเพื่อป้องกันไม่ให้น้ำควบแน่นบนพื้นผิวของอาหารเลี้ยงเชื้อ วิธีการเตรียม MS Agar ก่อนหน้านี้คล้ายคลึงกับวิธีการที่ Tanzer (18) อธิบายไว้
การแยกเชื้อ Streptococcus mutans ด้วยเทคนิคการเก็บคราบพลัค
เด็ก 10 คนที่ได้รับการวินิจฉัยว่าเป็นโรคฟันผุในเด็กระยะเริ่มต้นรุนแรง (SECC) อายุระหว่าง 2 ถึง 6 ปี ได้รับเชิญให้เข้าร่วมการเก็บคราบพลัคในช่องปาก ผู้ปกครองของเด็กได้รับข้อมูลทั้งหมดเกี่ยวกับจุดมุ่งหมายของขั้นตอนนี้และลงนามในเอกสารยินยอม ประชากรในการศึกษาคือผู้ชาย 4 คน (40%) และผู้หญิง 6 คน (60%)
การเก็บตัวอย่างแบบสลับกันระหว่างมื้ออาหารและการแปรงฟันอย่างน้อย 2 ชั่วโมง การเก็บคราบจุลินทรีย์จะทำได้จากทั้งด้านลิ้นของฟันกรามน้อยซี่ที่สองที่อยู่ด้านล่างและด้านแก้มของฟันกรามน้อยซี่ที่สองที่อยู่ด้านบนโดยใช้ไม้จิ้มฟันที่ผ่านการฆ่าเชื้อด้วยความร้อนชื้นในเครื่องฆ่าเชื้อแบบเปียก (JSAT-85; JSR®, Chungchungnam-Do, South Korea) เป็นเวลา 24 ชั่วโมง จากนั้นจึงย้ายตัวอย่างลงในหลอดทดลองของ Eppendorf (Seal-Rite® Scientific, Inc., Ocala, FL, USA) ที่มีน้ำเกลือธรรมดาที่ผ่านการฆ่าเชื้อ 1 มล. นำตัวอย่างมาทำให้เป็นเนื้อเดียวกันเป็นเวลา 1 นาทีเพื่อแยกวัสดุที่เก็บมาจากสำลี จากนั้นจึงเจือจางตัวอย่างแต่ละตัวอย่างโดยเติมน้ำเกลือธรรมดาที่ผ่านการฆ่าเชื้อ 0.1 มล. ลงในหลอดทดลองอีกหลอดหนึ่งที่มีน้ำเกลือธรรมดาที่ผ่านการฆ่าเชื้อ 0.9 มล. จากนั้นจึงเขย่าหลอดทดลองเพื่อทำให้เป็นเนื้อเดียวกัน จากนั้นเติมสารละลายก่อนหน้า 0.1 มิลลิลิตรลงในหลอดอีกหลอดหนึ่งซึ่งบรรจุน้ำเกลือธรรมดาที่ผ่านการฆ่าเชื้อ 0.9 มิลลิลิตร ซึ่งเป็นการเจือจางครั้งที่สอง และทำซ้ำจนถึงการเจือจางครั้งที่ห้า
ตัวอย่างได้รับการเพาะเลี้ยงภายใน 1 ชั่วโมงหลังจากช่วงเวลาการเก็บตัวอย่างในจานเพาะเชื้อที่มี Mitis Salivarius Bacitracin Agar จากการแขวนลอยครั้งสุดท้ายของแต่ละตัวอย่าง จากนั้นปลูก 50 μL ในจานเพาะเชื้อที่มีหมายเลขของตัวอย่าง เพื่อให้แน่ใจว่ากระจายตัวอย่างได้ทั่วพื้นผิวของวุ้นอย่างเท่าเทียมกัน จึงทำการแปรงซ้ำในทุกทิศทางในขณะที่หมุนจาน หลังจากผ่านไป 15 นาที ให้พลิกจานเพื่อให้แน่ใจว่าอาหารเลี้ยงเชื้อดูดซับแบคทีเรีย จากนั้นจึงฟักจานคว่ำที่อุณหภูมิ 37 °C เป็นเวลา 72 ชั่วโมงในตู้ฟักที่มี CO2 15% (Bacteriological Incubator 6640-01-071- 6596/National Appliance Heinicke Co. Tualatin, USA) วิธีการแยกเชื้อ Streptococcus mutans ก่อนหน้านี้เทียบได้กับวิธีการที่ Motisuki (19) อธิบาย กลุ่มแบคทีเรีย Streptococcus mutans ในอุดมคติจะมีลักษณะเป็นก้อนเล็ก ๆ หยาบ ๆ และเกาะกันเป็นก้อนบนพื้นผิววุ้น และอาจมีลักษณะเป็นฟองใสเนื่องจากซูโครสสังเคราะห์กลูแคนมากเกินไป (20) ทั้งการทดสอบคาตาเลส (ซึ่งเป็นลบ) และการย้อมแกรม (ซึ่งเป็นบวก) ดำเนินการกับกลุ่มแบคทีเรีย Streptococcus mutans แบบจำลองที่ผลิตขึ้นหลังจากการฟักไข่ นอกจากนี้ ยังได้รับการยืนยันว่าตัวอย่างที่แยกออกมาเป็นแบคทีเรีย Streptococcus mutans โดยการทดสอบปฏิกิริยาลูกโซ่โพลีเมอเรส (LightCycler® PRO System; Roche, Basel, Switzerland) ภายในสำนักงานพลังงานปรมาณูแห่งดามัสกัส ซีเรีย ซึ่งให้ผลบวกต่อแบคทีเรีย Streptococcus mutans จากนั้น สำเนาตัวอย่างที่แยกออกมาจะถูกเก็บไว้ในห้องปฏิบัติการของวิทยาลัยวิทยาศาสตร์ ภาควิชาพฤกษศาสตร์ ภายในอาหารแช่หัวใจและสมองที่อุณหภูมิ -80 °C (21) เพื่อใช้ในขั้นตอนการทดสอบความไวของแบคทีเรีย Streptococcus mutans ต่อวัสดุที่ศึกษาในงานวิจัยนี้ในภายหลัง
การกระตุ้นแบคทีเรียและการเตรียมจานอาหารศึกษา
ก่อนทาครีมฟันเป็นเวลา 48 ชั่วโมง เชื้อ Streptococcus mutans จะถูกกระตุ้นโดยการเพาะเลี้ยงบนจานเพาะเชื้อที่มีอาหารเลี้ยงเชื้อ Mueller-Hinton จากนั้นจึงนำโคโลนีจำลองมาเพาะเลี้ยงหลังจากเพาะเลี้ยงเป็นเวลา 24 ชั่วโมง และเพาะเลี้ยงอีกครั้งในหลอดอาหารเหลว (Brain Heart Infusion (BM0070; EO Labs, Bonnybridge, Scotland)) แล้วนำไปใส่ในตู้เพาะเลี้ยงที่อุณหภูมิ 37 องศาเซลเซียสเป็นเวลา 24 ชั่วโมงเพื่อให้ได้ตัวอย่างเชื้อ Streptococcus mutans ที่ยังมีชีวิตอยู่ นำตัวอย่างออกจากตู้เพาะเลี้ยง จากนั้นเขย่าหลอดทดลองและคนโดยใช้เครื่องหมุนวน (CSL-VORTEX, Thistle Scientific Ltd, Glasgow, United Kingdom) เป็นเวลา 1 นาที เพื่อให้ส่วนผสมทั้งหมดภายในหลอดทดลองผสมกันหมด
ความหนาแน่นของ Streptococcus mutans ถูกกำหนดที่ 0.5 ของมาตรฐาน McFarland (1.5×10^8 CFU/mL) โดยใช้ PhonexSpec (เครื่องวัดปริมาณเชื้อ BD PhoenixSpec™ 440910/ Becton, Dickinson and Co., Maryland 21152 USA) โดยนำปริมาณของอาหารเลี้ยงเชื้อที่มี Streptococcus mutans ออกมาจากหลอดก่อนหน้า แล้วค่อยๆ เติมลงในหลอดที่มีซีรั่มทางสรีรวิทยาที่ผ่านการฆ่าเชื้อ จนได้ความเข้มข้นที่ต้องการ
วุ้นถูกปรุงจากอาหาร Mueller-Hinton แล้วเทลงในจานเพาะเชื้อ 20 จาน (เส้นผ่านศูนย์กลาง 60 มม.) จากนั้นปล่อยให้แข็งตัวที่อุณหภูมิห้อง
ในการทดสอบ จะทำหลุมขนาดเส้นผ่านศูนย์กลาง 9 มม. จำนวน 3 หลุมในแต่ละแผ่นตลอดความหนาของวุ้น โดยเจาะลึกประมาณ 4 มม. ผ่านเครื่องเจาะที่ผ่านการฆ่าเชื้อ เขย่าสารละลายแบคทีเรียที่ควบคุมความขุ่นด้วยเครื่องวอร์เท็กซ์เป็นเวลา 30 วินาที จากนั้นใช้ไมโครปิเปตหยดสารละลายนี้ 100 μl ลงบนแผ่น แล้วกระจายให้ทั่วพื้นผิววุ้นผ่านปลายหลอดแก้วที่ผ่านการฆ่าเชื้อโดยหมุนไปทางซ้ายและขวาเป็นรูปตัว Z จากนั้นหมุนจาน 60 องศาโดยหมุนซ้ำแบบเดิม จากนั้นหมุนอีก 60 องศาโดยหมุนแบบเดิม ในที่สุด ให้ใช้แปรงทาด้วยการหมุนเป็นวงกลมที่ขอบจานเพื่อให้แน่ใจว่าจะกระจายทั่วแผ่น จากนั้นจึงทิ้งไว้ที่อุณหภูมิห้องเป็นเวลา 20–30 นาทีเพื่อให้แบคทีเรียถูกดูดซับ วิธีการก่อนหน้านี้ในการกระตุ้น Streptococcus mutans และการเตรียมอาหารศึกษาสามารถเปรียบเทียบได้กับวิธีการที่ Prasanth (22) อธิบายไว้
การประเมินฤทธิ์ต้านเชื้อแบคทีเรียของยาสีฟันด้วยวิธีการแพร่กระจายด้วยวุ้น
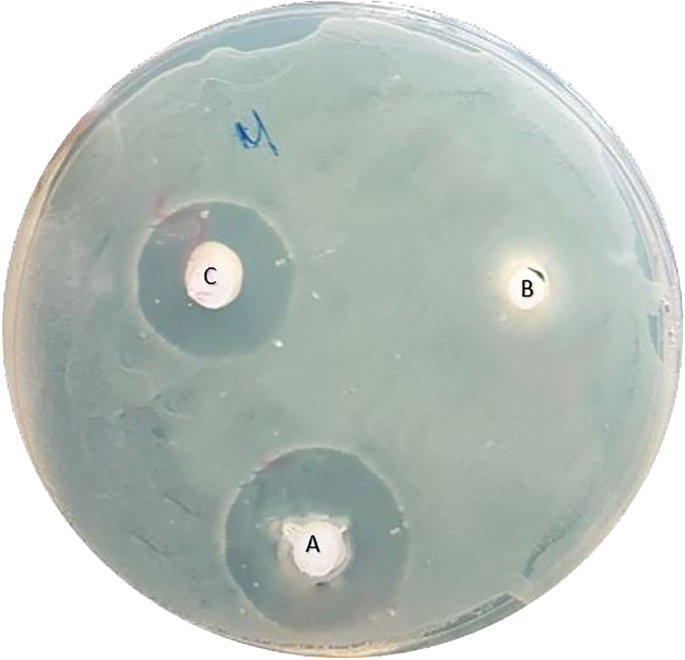
ยาสีฟันที่ใช้ในการศึกษาแสดงไว้ในตารางที่ 1
ยาสีฟันที่ทดสอบ ได้แก่ BioMin F (BioMin Technologies Ltd, Stoke-on-Trent, UK), NovaMin (GSK Sensodyne; Brentford, Middlesex, United Kingdom) และ Signal (Unilever, Ho Chi Minh City, Vietnam) บรรจุด้วยไซริงค์อินซูลินปลอดเชื้อก่อนจะนำไปใช้ทันทีเพื่อให้ทำงานได้ง่ายขึ้นและนำไปใส่ในหลุมที่ระบุในถาด ยาสีฟันแต่ละชิ้นจะถูกวางในแต่ละหลุมและเข้ารหัสหลุมที่ด้านหลังของถาด และแต่ละถาดจะถูกเข้ารหัสด้วยหมายเลขเฉพาะ จากนั้นจึงนำถาดคว่ำลงที่อุณหภูมิ 37 องศาโอ้C เป็นเวลา 24 ชั่วโมงใน CO 15%2 ตู้ฟักไข่ โซนยับยั้งรอบ ๆ ยาสีฟันแต่ละชิ้นสังเกตได้จากการกำจัดกลุ่มแบคทีเรียรอบ ๆ หลุม (รูปที่ 1) จากนั้นวัดวงกลมเป็นมิลลิเมตรด้วยคาลิปเปอร์ดิจิทัล (WEN Digital Caliper, Performance Tool – Wilmar LLC, Kent, Washington, USA) เส้นผ่านศูนย์กลางของโซนยับยั้งที่มากขึ้นหมายความว่าส่วนผสมที่ทดสอบมีฤทธิ์ต้านเชื้อแบคทีเรียที่มากขึ้น
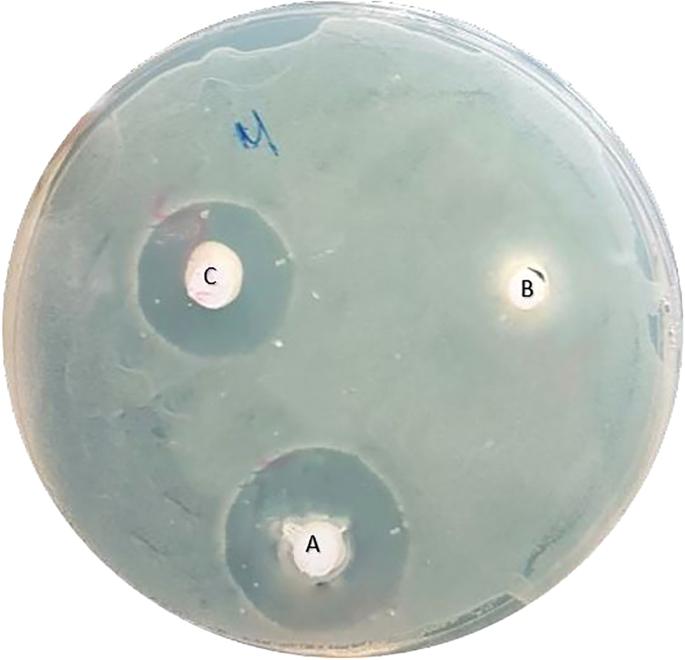
จานเพาะเชื้อหลังจากการฟักเป็นเวลา 24 ชั่วโมง (เอ) BioMin F ดี, (บี) NovaMin ดี และ (ซี) สัญญาณดี.
วิธีการก่อนหน้านี้ในการประเมินความสามารถในการต่อต้านแบคทีเรียของยาสีฟันด้วยวิธีการแพร่กระจายของวุ้นนั้นเปรียบเทียบได้กับวิธีการที่ Prasanth (22) อธิบายไว้
การวิเคราะห์ทางสถิติ
สถิติเชิงพรรณนาและการวิเคราะห์ทางสถิติทำได้โดยใช้โปรแกรม SPSS 17 (Statistical Package for Social Science, SPSS, เวอร์ชัน 17.0, SPSS, Chicago, IL, USA) การทดสอบ Shapiro–Wilk แสดงให้เห็นการกระจายแบบปกติของเส้นผ่านศูนย์กลางของโซนยับยั้งของหลุมยาสีฟัน การทดสอบ One-way ANOVA ใช้สำหรับการเปรียบเทียบระหว่างกลุ่ม และใช้การทดสอบ Bonferroni สำหรับการเปรียบเทียบเป็นคู่ พี ค่า